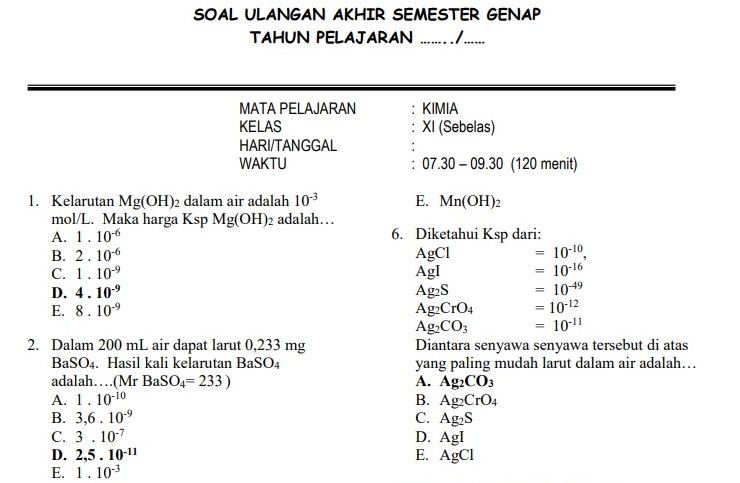
Semester 2 kelas 11 Kimia merupakan periode penting yang menjembatani pemahaman konsep dasar dengan aplikasi yang lebih kompleks. Penguasaan materi di semester ini akan sangat membantu dalam persiapan menghadapi ujian, baik ujian semester maupun ujian masuk perguruan tinggi. Untuk membantu siswa menguasai materi dengan lebih baik, artikel ini akan menyajikan bank soal kimia kelas 11 semester 2 yang komprehensif, lengkap dengan pembahasan dan tips belajar efektif.
Mengapa Bank Soal Penting?
Bank soal memiliki peran krusial dalam proses belajar. Berikut beberapa alasan mengapa bank soal penting untuk dipelajari:
- Memperdalam Pemahaman Konsep: Mengerjakan soal memaksa siswa untuk menerapkan konsep yang telah dipelajari. Proses ini membantu memperkuat pemahaman dan mengidentifikasi area yang masih lemah.
- Melatih Kemampuan Analitis: Soal kimia seringkali membutuhkan analisis dan interpretasi data. Mengerjakan berbagai jenis soal membantu melatih kemampuan analitis dan problem-solving.
- Mengenali Pola Soal: Dengan mengerjakan berbagai jenis soal, siswa akan familiar dengan pola soal yang sering muncul dalam ujian. Ini akan membantu meningkatkan kecepatan dan ketepatan dalam menjawab soal.
- Mengukur Tingkat Penguasaan Materi: Bank soal berfungsi sebagai alat evaluasi diri untuk mengetahui sejauh mana penguasaan materi. Hasil evaluasi ini dapat digunakan untuk fokus pada materi yang perlu diperdalam.
- Meningkatkan Kepercayaan Diri: Dengan berlatih secara teratur, siswa akan merasa lebih siap dan percaya diri dalam menghadapi ujian.

Topik-Topik Utama Kimia Kelas 11 Semester 2
Sebelum masuk ke contoh soal, mari kita tinjau topik-topik utama yang biasanya dibahas dalam Kimia kelas 11 semester 2:
- Termokimia: Mempelajari tentang perubahan energi yang menyertai reaksi kimia, termasuk entalpi, hukum Hess, dan energi ikatan.
- Laju Reaksi: Mempelajari tentang faktor-faktor yang mempengaruhi laju reaksi, seperti konsentrasi, suhu, katalis, dan luas permukaan.
- Kesetimbangan Kimia: Mempelajari tentang keadaan kesetimbangan dinamis dalam reaksi reversible, konstanta kesetimbangan, dan faktor-faktor yang mempengaruhi kesetimbangan (asas Le Chatelier).
- Larutan Asam dan Basa: Mempelajari tentang konsep asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis, pH, pOH, indikator asam basa, dan titrasi asam basa.
- Hidrolisis Garam: Mempelajari tentang reaksi garam dengan air yang menghasilkan asam atau basa, dan jenis-jenis hidrolisis garam.
- Larutan Buffer (Penyangga): Mempelajari tentang larutan yang mampu mempertahankan pH-nya ketika ditambahkan sedikit asam atau basa, dan aplikasi larutan buffer.
- Kelarutan dan Hasil Kali Kelarutan (Ksp): Mempelajari tentang kelarutan suatu zat dalam pelarut tertentu, faktor-faktor yang mempengaruhi kelarutan, dan hubungan antara kelarutan dengan Ksp.
- Koloid: Mempelajari tentang sistem dispersi koloid, sifat-sifat koloid (efek Tyndall, gerak Brown, adsorpsi, koagulasi, dialisis), dan jenis-jenis koloid.
Contoh Soal dan Pembahasan
Berikut adalah beberapa contoh soal dari masing-masing topik beserta pembahasannya:
1. Termokimia
-
Soal: Diketahui reaksi: N2(g) + 3H2(g) → 2NH3(g) ΔH = -92 kJ. Hitunglah kalor yang dibebaskan jika 14 gram N2 bereaksi dengan sempurna. (Ar N = 14)
- Pembahasan:
- Mol N2 = massa/Ar = 14 gram / 14 g/mol = 1 mol
- Dari persamaan reaksi, 1 mol N2 menghasilkan kalor sebesar 92 kJ.
- Jadi, kalor yang dibebaskan = 92 kJ
- Pembahasan:
-
Soal: Diketahui:
-
C(s) + O2(g) → CO2(g) ΔH = -393,5 kJ
-
H2(g) + ½O2(g) → H2O(l) ΔH = -285,8 kJ
-
2C2H2(g) + 5O2(g) → 4CO2(g) + 2H2O(l) ΔH = -2598,8 kJ
Hitung ΔH untuk reaksi: C(s) + H2(g) → C2H2(g) -
Pembahasan: Menggunakan hukum Hess, kita susun persamaan reaksi sedemikian rupa sehingga reaksi yang diinginkan diperoleh:
- 2 [C(s) + O2(g) → CO2(g)] ΔH = 2(-393,5 kJ) = -787 kJ
- 2 [H2(g) + ½O2(g) → H2O(l)] ΔH = 2(-285,8 kJ) = -571,6 kJ
- 4CO2(g) + 2H2O(l) → 2C2H2(g) + 5O2(g) ΔH = +2598,8 kJ
- Jumlahkan ketiga reaksi: 2C(s) + 2H2(g) → 2C2H2(g) ΔH = -787 – 571,6 + 2598,8 = 1240,2 kJ
- Maka, untuk reaksi C(s) + H2(g) → C2H2(g) ΔH = 1240,2 kJ / 2 = 620,1 kJ
-
2. Laju Reaksi
-
Soal: Reaksi 2NO(g) + O2(g) → 2NO2(g) memiliki data eksperimen sebagai berikut:
[NO] (M) [O2] (M) Laju Reaksi (M/s) 0.1 0.1 0.002 0.1 0.2 0.004 0.2 0.1 0.008 Tentukan orde reaksi terhadap NO dan O2, serta persamaan laju reaksinya.
- Pembahasan:
- Bandingkan percobaan 1 dan 2: [NO] tetap, [O2] naik 2x, laju naik 2x. Maka, orde reaksi terhadap O2 adalah 1.
- Bandingkan percobaan 1 dan 3: [O2] tetap, [NO] naik 2x, laju naik 4x. Maka, orde reaksi terhadap NO adalah 2.
- Persamaan laju reaksi: v = k[NO]2[O2]
- Pembahasan:
-
Soal: Suatu reaksi berlangsung 2 kali lebih cepat setiap kenaikan suhu 10°C. Jika pada suhu 20°C reaksi berlangsung selama 12 menit, berapa lama reaksi akan berlangsung pada suhu 50°C?
- Pembahasan: Kenaikan suhu = (50-20)/10 = 3 kali
- Laju reaksi akan menjadi 23 = 8 kali lebih cepat.
- Waktu reaksi akan menjadi 12 menit / 8 = 1.5 menit
- Pembahasan: Kenaikan suhu = (50-20)/10 = 3 kali
3. Kesetimbangan Kimia
-
Soal: Dalam wadah 2 liter, terdapat 4 mol N2O4 yang terurai menjadi 2 mol NO2 pada saat kesetimbangan. Tentukan nilai Kc untuk reaksi: N2O4(g) ⇌ 2NO2(g)
- Pembahasan:
- [N2O4] awal = 4 mol / 2 L = 2 M
- Karena 2 mol NO2 terbentuk, maka 1 mol N2O4 terurai.
- [N2O4] setimbang = 2 M – (1 mol / 2 L) = 1.5 M
- [NO2] setimbang = 2 mol / 2 L = 1 M
- Kc = [NO2]2 / [N2O4] = (1)2 / 1.5 = 0.67
- Pembahasan:
-
Soal: Reaksi kesetimbangan: N2(g) + 3H2(g) ⇌ 2NH3(g) ΔH = -92 kJ. Faktor-faktor apa saja yang dapat meningkatkan produksi NH3?
- Pembahasan: Berdasarkan asas Le Chatelier:
- Menurunkan suhu: Karena reaksi eksoterm (ΔH < 0), menurunkan suhu akan menggeser kesetimbangan ke kanan (ke arah produk).
- Meningkatkan tekanan: Karena jumlah mol gas di ruas kiri (4 mol) lebih besar dari ruas kanan (2 mol), meningkatkan tekanan akan menggeser kesetimbangan ke kanan.
- Menambahkan N2 atau H2: Menambahkan reaktan akan menggeser kesetimbangan ke kanan.
- Mengurangi NH3: Mengurangi produk akan menggeser kesetimbangan ke kanan.
- Pembahasan: Berdasarkan asas Le Chatelier:
4. Larutan Asam dan Basa
-
Soal: Hitung pH larutan HCl 0.01 M.
- Pembahasan: HCl adalah asam kuat, sehingga [H+] = [HCl] = 0.01 M = 10-2 M
- pH = -log [H+] = -log (10-2) = 2
- Pembahasan: HCl adalah asam kuat, sehingga [H+] = [HCl] = 0.01 M = 10-2 M
-
Soal: Suatu larutan memiliki pH 9. Tentukan pOH larutan tersebut.
- Pembahasan: pH + pOH = 14
- pOH = 14 – pH = 14 – 9 = 5
- Pembahasan: pH + pOH = 14
5. Hidrolisis Garam
-
Soal: Tuliskan reaksi hidrolisis untuk garam NH4Cl.
- Pembahasan: NH4Cl berasal dari asam kuat HCl dan basa lemah NH4OH. Kation NH4+ akan terhidrolisis:
- NH4+(aq) + H2O(l) ⇌ NH3(aq) + H3O+(aq)
- Pembahasan: NH4Cl berasal dari asam kuat HCl dan basa lemah NH4OH. Kation NH4+ akan terhidrolisis:
-
Soal: Apakah larutan NaCN bersifat asam, basa, atau netral? Jelaskan.
- Pembahasan: NaCN berasal dari asam lemah HCN dan basa kuat NaOH. Anion CN– akan terhidrolisis:
- CN–(aq) + H2O(l) ⇌ HCN(aq) + OH–(aq)
- Karena menghasilkan OH–, larutan NaCN bersifat basa.
- Pembahasan: NaCN berasal dari asam lemah HCN dan basa kuat NaOH. Anion CN– akan terhidrolisis:
6. Larutan Buffer (Penyangga)
-
Soal: Campuran larutan yang mana yang akan membentuk larutan buffer?
-
a) 50 mL HCl 0.1 M + 50 mL NaOH 0.1 M
-
b) 50 mL HCl 0.1 M + 50 mL NH4OH 0.2 M
-
c) 50 mL HCl 0.2 M + 50 mL NH4OH 0.1 M
-
d) 50 mL HCl 0.1 M + 50 mL NaCl 0.1 M
-
Pembahasan: Larutan buffer terbentuk dari asam lemah dan basa konjugasinya, atau basa lemah dan asam konjugasinya.
- a) menghasilkan garam netral, bukan buffer.
- b) HCl bereaksi dengan NH4OH, menghasilkan NH4Cl (garam) dan air. Karena NH4OH berlebih, akan terbentuk buffer basa (NH4OH dan NH4Cl).
- c) HCl berlebih, bukan buffer.
- d) NaCl adalah garam netral, bukan buffer.
- Jawaban: b
-
-
Soal: Hitung pH larutan buffer yang mengandung 0.1 M CH3COOH dan 0.1 M CH3COONa (Ka CH3COOH = 1.8 x 10-5).
- Pembahasan: Menggunakan persamaan Henderson-Hasselbalch:
- pH = pKa + log [CH3COO–] / [CH3COOH]
- pKa = -log Ka = -log (1.8 x 10-5) = 4.74
- pH = 4.74 + log (0.1 / 0.1) = 4.74
- Pembahasan: Menggunakan persamaan Henderson-Hasselbalch:
7. Kelarutan dan Hasil Kali Kelarutan (Ksp)
-
Soal: Tuliskan persamaan Ksp untuk AgCl(s) ⇌ Ag+(aq) + Cl–(aq)
- Pembahasan: Ksp = [Ag+][Cl–]
-
Soal: Kelarutan AgCl dalam air adalah 1.34 x 10-5 M. Hitung Ksp AgCl.
- Pembahasan: Karena kelarutan AgCl adalah 1.34 x 10-5 M, maka [Ag+] = [Cl–] = 1.34 x 10-5 M
- Ksp = [Ag+][Cl–] = (1.34 x 10-5)2 = 1.8 x 10-10
- Pembahasan: Karena kelarutan AgCl adalah 1.34 x 10-5 M, maka [Ag+] = [Cl–] = 1.34 x 10-5 M
8. Koloid
-
Soal: Sebutkan contoh penerapan sifat adsorpsi koloid dalam kehidupan sehari-hari.
- Pembahasan:
- Penggunaan norit (arang aktif) untuk menjernihkan air.
- Penggunaan tawas untuk menjernihkan air.
- Proses pemutihan gula tebu dengan menggunakan tanah diatom.
- Pembahasan:
-
Soal: Jelaskan perbedaan antara sol, emulsi, dan buih.
- Pembahasan:
- Sol: Sistem koloid dengan fase terdispersi padat dan medium pendispersi cair. Contoh: cat, tinta.
- Emulsi: Sistem koloid dengan fase terdispersi cair dan medium pendispersi cair. Contoh: susu, santan.
- Buih: Sistem koloid dengan fase terdispersi gas dan medium pendispersi cair. Contoh: busa sabun, whipped cream.
- Pembahasan:
Tips Belajar Efektif Kimia Kelas 11 Semester 2
- Pahami Konsep Dasar: Jangan hanya menghafal rumus, pahami konsep di balik rumus tersebut.
- Buat Catatan yang Rapi: Catat poin-poin penting, rumus, dan contoh soal.
- Kerjakan Soal Secara Rutin: Semakin banyak soal yang dikerjakan, semakin terlatih kemampuan problem-solving.
- Diskusikan dengan Teman: Belajar bersama teman dapat membantu memahami materi dari sudut pandang yang berbeda.
- Manfaatkan Sumber Belajar: Gunakan buku teks, modul, internet, dan sumber belajar lainnya.
- Jangan Takut Bertanya: Jika ada materi yang kurang dipahami, jangan ragu untuk bertanya kepada guru atau teman.
- Jaga Kesehatan: Istirahat yang cukup dan makan makanan yang bergizi agar tetap fokus dan semangat belajar.
Kesimpulan
Bank soal Kimia kelas 11 semester 2 ini diharapkan dapat menjadi panduan yang komprehensif bagi siswa dalam mempersiapkan diri menghadapi ujian. Dengan mempelajari materi secara mendalam, mengerjakan soal secara rutin, dan menerapkan tips belajar efektif, siswa akan mampu menguasai materi Kimia dengan baik dan meraih hasil yang memuaskan. Selamat belajar!




